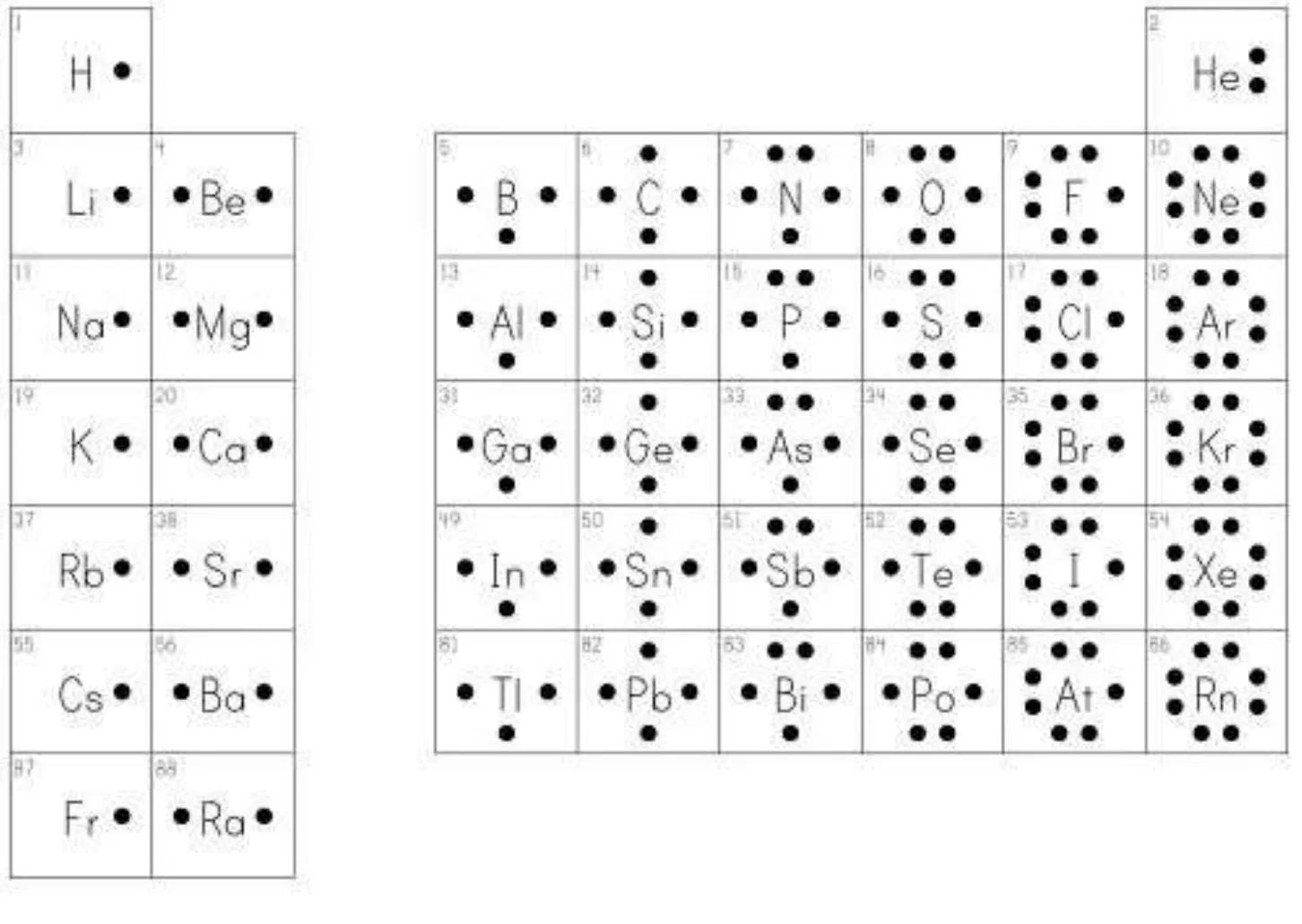
Regla del octeto
los electrones en todos los gases nobles estan distribuidos de tal manera que su nivel de valencia se encuentra ocupado por ocho electrones.
el hidrogeno y el litio son elementos que cumplen con la regla del dueto, ya que solo son estables con dos electrones.
Estructura de lewis: se transfieren y comparten electrones en los enlaces quimicos
Gilbert Newton Lewis(1875-1946): químico estadounidense, enseñó química en la universidad de harvard y en el instituto de tecnología de massachusetts. Creo una teoría sobre la atracción y la valencia químicas, con base en la estructura atómica de las sustancias
Enlace químico: Una vez conocida la estructura y el comportamiento de los átomos, lo siguiente fue comprender cómo estaban unidos entre sí. Científicos como Abegg, Kossel, Lewis, Langmuir y Drude, entre otros, establecieron modelos teóricos que explican lo que ocurre cuando los átomos se unen.
Enlace iónico: las sales de la naturaleza y los óxidos son ejemplos de sustancias formadas por enlaces iónicos. Estos compuestos iónicos tienen multiples aplicaciones, que van desde la joyería hasta la producción de corriente eléctrica. El sodio es un metal y, por consiguiente, tiene valores de energía de ionizacion pequeños, lo que permite su fácil conversión a ion positivo. El cloro es un no metal con valores de afinidad electrónica altos, por lo que se convierte fácilmente en un ion negativo. A partir de tales caracteristicas, cuando el sodio y el cloro se acercan, el cloro atrae al unico electron de valencia del sodio.
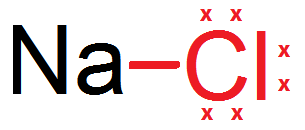
Cuando se efectúan enlaces ionicos entre metales y el no metal oxígeno, los compuestos resultantes se conocen como óxidos.
Linus Carl Pauling: propuso el método de diferencia de electronegatividades (dE) para predecir el tipo de enlace al formarse un compuesto.
dE>1.7= Iónico
dE<1.7= Covalente
Enlace covalente no polar y polar: la atmosfera terrestre esta constituida principalmente por nitrogeno(N) y oxígeno(O). Gilbert N. Lewis propuso un modelo de enlace químico en el que los átomos que se enlazan comparten electrones, de tal manera que ambos átomos completan su octeto y adquieren la configuración de un gas noble.
H2:
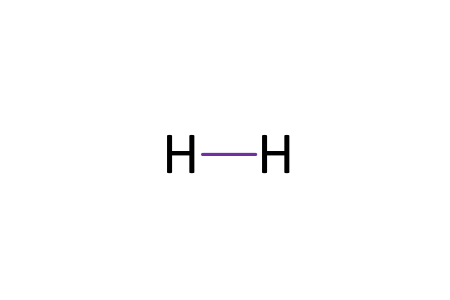
el enlace covalente se forma al combinarse dos orbitales atómicos cada uno con un electrón desapareado. De acuerdo con la tabla de electronegatividades de Pauli, cada elemento presenta un valor determinado de electronegatividad; en consecuencia, en un enlace covalente, el par electrónico es atraído con más intensidad por el átomo de electronegatividad mayor.
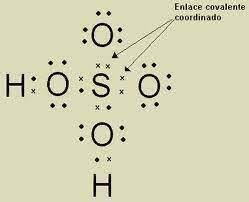
Enlace covalente coordinado: el par electrónico compartido es proporcionado por uno de los átomos participantes en la unión. Al formarse, la carga eléctrica se distribuye en todo el ion amonio.
Enlaces covalentes multiples: cuando dos átomos comparten un par electrónico se forma un enlace covalente simple. Pero, debido a la estructura electrónica de algunos átomos, estos logran una configuracion de gas noble al compartir dos o incluso tres pares de electrones
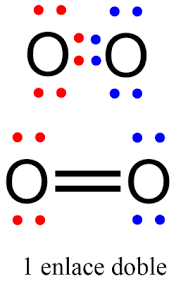
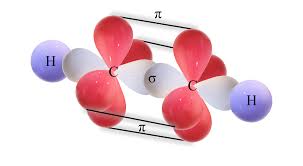
A los enlaces covalentes simples tambien se le conoce como enlaces sigma. Estos se forman por la superposición de dos orbitales s. un s con un p o un p con otro p. En los enlaces múltiples se presentan los enlaces pi, que se forman cuando se superponen en posición paralela orbitales p para compartir electrones. Los enlaces pi se ubican situado por encima y por debajo de la línea que representa el plano donde se unen los átomos
Estructura de lewis para compuestos covalentes:
- identificar el átomo central que actuará como punto de partida para acomodar los demás a su alrededor
- Sumar los electrones de valencia de todos los átomos que constituyen la molécula (A); si se trata de un ion negativo, al final se suman sus cargas negativas; por el contrario, si es un ion positivo, se restan.
- Con base en la regla del octeto, determinar el total de electrones que caben en la capa de valencia de todos los átomos de la molecula (B)
- Calcular el número de electrones enlazantes (C)
- Para conocer el numero de enlaces covalentes que hay en la molecula, dividir C entre dos.
- Determinar el número de electrones no compartidos.
- Dibujar la estructura de la molecula o ion poliatómico.
- Confirmar si la estructura de la molécula o ion poliatómico es la adecuada; una forma de hacerlo es estableciendo la carga formal (CF) de cada átomo. Para ello se debe tener en cuenta que una molécula estable es eléctricamente neutra, por lo que la suma de sus cargas es igual a cero.
Geometría molecular: estas son resultados de la distribución de sus átomos en el espacio.

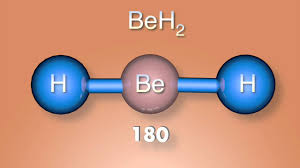
Forma lineal
Triangular plana
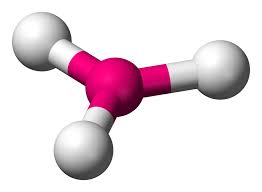
Tetraédrica
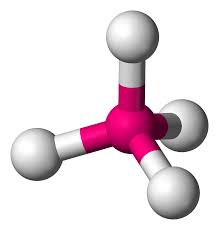
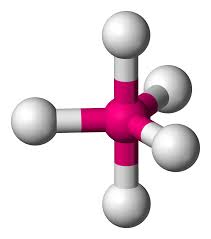
Bipiramidal trigonal
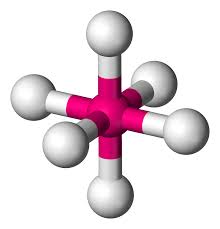
Octaédrica
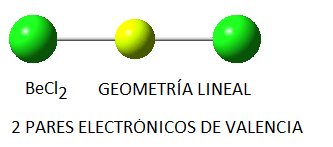
Ejemplos
BeCl2
BF3
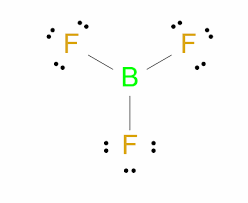
Propiedades de compuestos covalentes: a temperatura ambiente, los compuestos covalentes con masas molares pequeñas[nitrógeno (N2), oxígeno (O2), metano (CH4), entre otros] suelen encontrarse en estado gaseoso; pero a medida que la masa aumenta [ácido acético (CH3COOH), agua (H2O), etanol (CH3CH2OH), etc.]
Enlace covalente no polar: insolubles en agua, pero muy solubles en disolventes no polares, puntos de fusión en estado sólido bajos y puntos de ebullición menores que los compuestos polares, puntos de ebullición bajos en estado liquido, aislantes del calor y la electricidad, gases o compuestos muy volátiles a temperatura ambiente.
Enlace covalente polar: solubles en disolventes polares como el agua, puntos de fusión en estado sólido mayores, en estado liquido puntos de fusión mayores, conductores de la electricidad al ser disueltos en agua, los compuestos liquidos son menos densos que el agua.
Enlace metálico: cuando los metales se unen, no se forman compuestos, sino una interacción que mantiene unidos sus átomos.
Mar de electrones libres: este modelo supone que los átomos de un sólido metálico se encuentran empaquetados relativamente juntos en una ordenación sistemática o estructura cristalina.
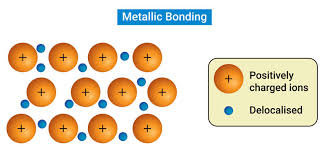
Bandas de energía: los átomos estan tan cerca unos de otros que sus orbitales atómicos se superponen entre sí y dan lugar a un conjunto de orbitales moleculares de energías similares que se describen mejor como una banda de niveles energéticos.
Implicaciones socioeconómicas por la corrosión de los metales: la corrosión u oxidación es el término que se le aplica al proceso mediante la cual los metales sin combinar interaccionan con el medio que los rodea y se transforma en compuestos.
