Estequiometría: estudia las relaciones numéricas relativas a la composición de la materia y sus transformaciones
Mol: representa un monton/masa de cualquier sustancia. El número de partículas en un mol es de 6.022x10^23


Volumen molar: aplicable a los gases, volumen ocupado por un gas en condiciones normales y corresponde a 22.4L
REACTIVO LIMITANTE
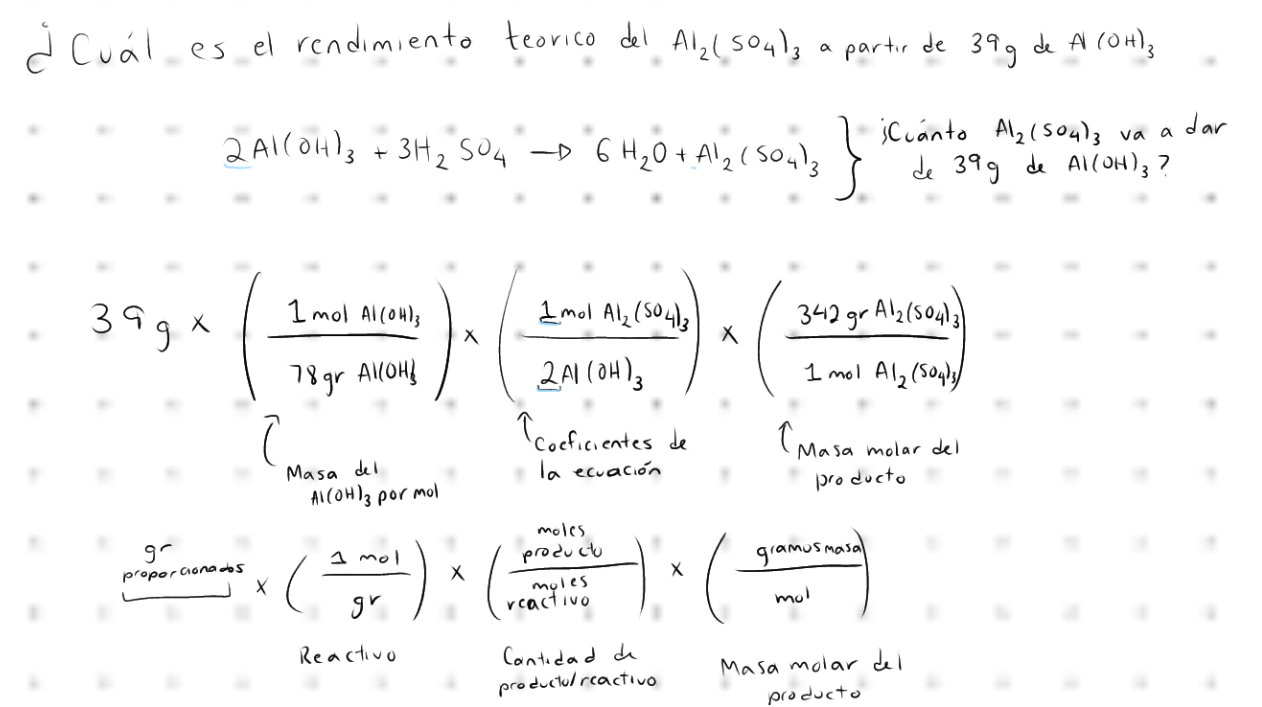
Sustancia que se encuentra en menor proporción de acuerdo con los coeficientes de una ecuación, es el reactivo que se consume antes del resto de los demás en la reacción.

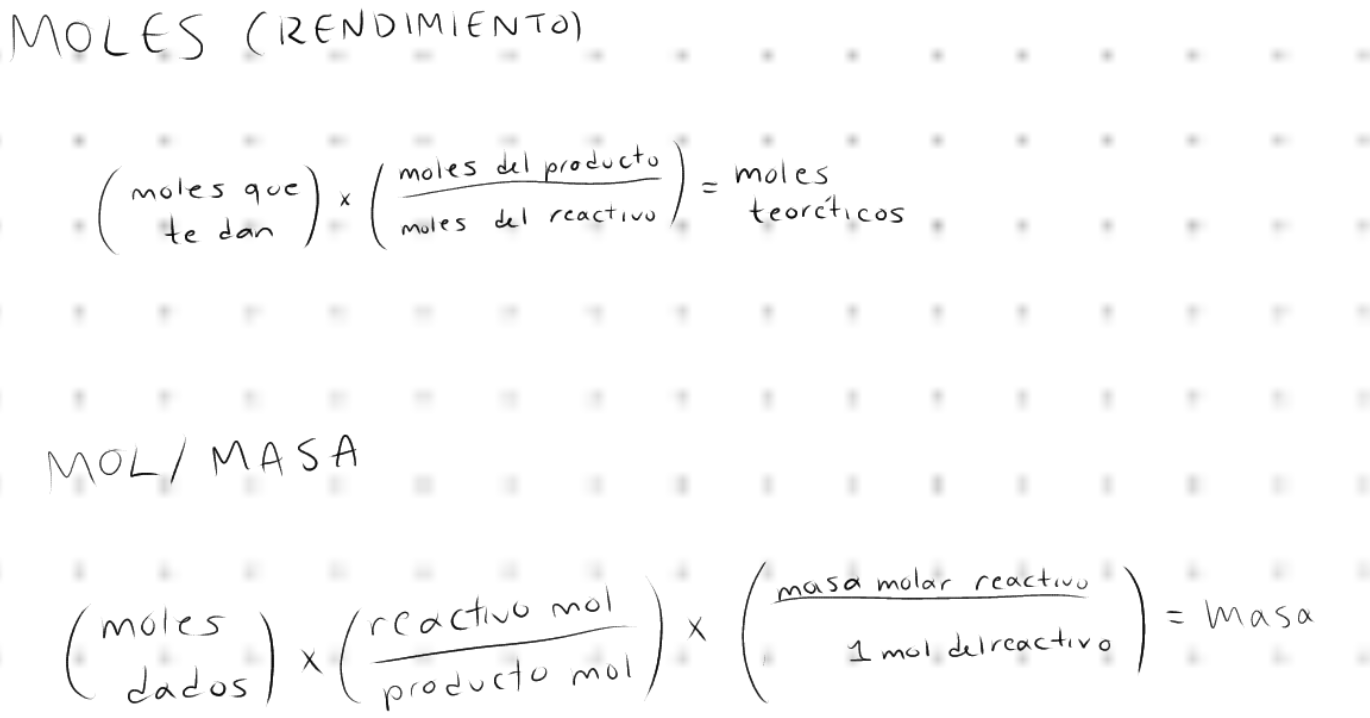
Rendimiento: es la relación porcentual entre la cantidad de producto obtenido y la cantidad de productos esperado según los cálculos estequiométricos

Determina el pH de una solución cuya concentración de H es de 2x10^-9.
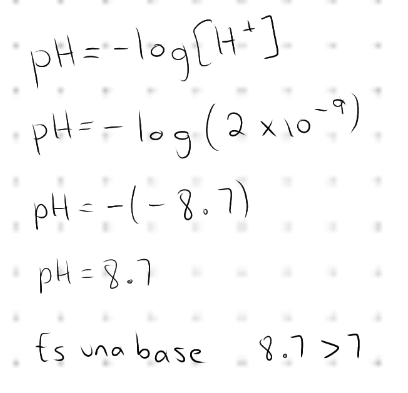
Ácidos
-
Tienen un sabor agrio.
-
Cambian el papel tornasol azul a rojo.
-
Son corrosivos.
-
Reaccionan con metales liberando hidrógeno (H₂).
-
Tienen un pH menor a 7.
-
Aumentan la concentración de iones hidrógeno (H⁺) en solución acuosa.
Bases
-
Tienen un sabor amargo.
-
Tienen una textura jabonosa al tacto.
-
Cambian el papel tornasol rojo a azul.
-
Son corrosivas en altas concentraciones.
-
Tienen un pH mayor a 7.
-
Aumentan la concentración de iones hidroxilo (OH⁻) en solución acuosa.
Teorías que describen ácidos y bases
Teoría de Arrhenius:
-
Ácido: Sustancia que aumenta la concentración de iones hidrógeno (H⁺) en solución acuosa.
-
Base: Sustancia que aumenta la concentración de iones hidroxilo (OH⁻) en solución acuosa.
-
Limitación: Solo aplica en soluciones acuosas.
Teoría de Brønsted-Lowry:
-
Ácido: Sustancia que dona protones (H⁺).
-
Base: Sustancia que acepta protones (H⁺).
-
Ventaja: Más general, no requiere que la sustancia esté disuelta en agua.
Teoría de Lewis:
-
Ácido: Sustancia que acepta un par de electrones.
-
Base: Sustancia que dona un par de electrones.
-
Ventaja: Es la definición más amplia y aplica en reacciones no acuosas.


